- CYCLANES ET CYCLÈNES
- CYCLANES ET CYCLÈNESLes cyclanes (ou cyclo-alcanes) sont des hydrocarbures comportant un ou plusieurs cycles d’atomes de carbone unis par des liaisons simples. Les cyclanes simples, non substitués, de formule générale (CH2)n constituent une série homologue particulièrement intéressante, car leurs synthèses et leurs propriétés chimiques varient de façon frappante avec la taille du cycle, différant nettement en cela des alcanes correspondants CH3 漣 (CH2)n-2 漣 CH3. Les raisons de ces différences entre les cyclanes et les alcanes sont d’ordre structural; elles font intervenir deux éléments fondamentaux: la tension angulaire et l’encombrement stérique.Les cyclènes (ou cyclo-alcènes) sont des hydrocarbures du même type, mais ils comportent, dans le cycle, une double liaison carbone-carbone. Aux particularités des composés carbonés cycliques ils joignent celles des hydrocarbures non saturés classiques, les alcènes, les unes et les autres dépendant directement de la taille du cycle et devenant nettement anormales pour les petits cycles.L’étude des cyclanes et des cyclènes relève surtout de la chimie organique fondamentale. Elle a permis le développement des concepts de stéréo-isomérie, de configuration, de conformation, etc., des molécules organiques, et elle est à la base de nos connaissances actuelles sur la structure de nombre d’entre elles, telles que les substances naturelles, la plupart cycliques, que sont les terpénoïdes, les stéroïdes, etc.GénéralitésDéfinition et nomenclatureLe domaine des cyclanes rassemble, en principe, les composés hydrocarbonés cycliques ne comportant que des liaisons simples C 漣 C dans le cycle, et celui des cyclènes les mêmes composés, mais comportant une double liaison C 略C dans le cycle. Les cyclanes et les cyclènes simples (tabl. 1) sont nommés d’après le nombre de carbones de leur cycle, le nom de l’alcane ou de l’alcène correspondant étant précédé du préfixe cyclo -; les substituants éventuels sont numérotés de façon telle que la somme de ces numéros soit la plus basse possible; ainsi les p -menthanes (1 et 2) sont des méthyl-1 isopropyl-4 cyclohexanes; dans les cyclènes, les numéros 1 et 2 sont ceux des carbones de la double liaison. Par extension, on considère aussi comme des cyclènes les composés tels que le méthylènecyclopropane (3), n’ayant qu’un carbone doublement lié faisant partie du cycle, ou le limonène (4) qui comporte deux doubles liaisons, dont une seule fait partie du cycle.Les hydrocarbures polycycliques sont aussi considérés comme des cyclanes s’ils sont saturés et comme des cyclènes s’ils comportent une double liaison (tabl. 2). Leur nomenclature est souvent complexe, d’autant que nombre d’entre eux sont des produits naturels ou dérivent de produits naturels, qui souvent ont conservé des noms vulgaires. Dans la molécule, deux cycles peuvent avoir deux ou plusieurs carbones communs, comme dans les décalines (5 et 6), ou un seul, comme le spirohexane (7) qui est un spirane; l’hydrocarbure tétracyclique (8), le cholestane, constitue le squelette carboné de base de nombreux stéroïdes. L’ 見-pinène (9), le camphène (10) et le cédrène (11) sont des exemples de cyclènes polycycliques.Stéréo-isomérie et structureOn rencontre dans ces composés tous les types d’isomérie: l’isomérie cyclanique chez les cyclanes simples au moins disubstitués, par exemple les cis et trans-p -menthanes (1 et 2), ou chez les composés bicycliques, telle la décaline qui est connue sous deux formes cis (5) et trans (6); l’isomérie éthylénique chez les cyclènes dont le cycle comporte au moins huit carbones, la possibilité apparaissant alors d’une géométrie trans pour la double liaison; l’isomérie optique chez tous ceux qui comportent au moins un carbone asymétrique, comme le limonène (4) qui est connu sous ses formes droite et gauche.La stéréochimie précise de tous ces composés constitue un énorme problème, par suite du nombre souvent très grand d’isomères possibles qu’il faut envisager quand on étudie la structure ou quand on fait la synthèse de telles substances. Pour les différencier dans l’écriture, on utilise divers symbolismes, par exemple des liaisons grasses et en pointillés – cas des p -menthanes (1 et 2) –, ou l’on précise par ces mêmes liaisons la géométrie des hydrogènes liés aux carbones de jonction – cas des décalines cis (5) et trans (6) –, donc la géométrie de ces jonctions.Les molécules des composés polycycliques sont toutes plus ou moins rigides; il n’en va pas de même pour les molécules des composés monocycliques, presque toutes flexibles et qui peuvent en principe adopter diverses conformations dont l’une est favorisée; par exemple, la forme «chaise», à isopropyle et méthyle équatoriaux (2 ) pour le trans-p -menthane (2); la même «chaise» mais à méthyle axial (1 ) pour l’isomère cis (1). On peut dire que, mis à part le cyclopropane et le cyclopropène qui sont nécessairement plans, tous les autres cyclanes et cyclènes du tableau 1 adoptent une conformation privilégiée non plane.PropriétésLes propriétés physiques des cyclanes et des cyclènes ne présentent pas de particularités très remarquables. On notera seulement que les points de fusion et les points d’ébullition des cyclanes simples sont plus élevés que ceux des alcènes correspondants; tous les composés des tableaux 1 et 2 sont néanmoins liquides à la température ordinaire.D’une façon générale, parce que ne présentant pas de point d’attaque face aux réactifs, les cyclanes comme les alcanes sont inertes dans la plupart des réactions, mis à part les cyclopropane, cyclobutane et leurs dérivés qui, par suite de la tension existant dans la molécule, ont une réactivité intermédiaire entre celle des composés saturés et celle des composés éthyléniques (tabl. 3). Cette tension (théorie de Baeyer) apparaît claire lorsque l’on compare les chaleurs de combustion des différents cyclanes. On constate, par exemple, que la chaleur de combustion par unité CH2, qui est de 658 kJ pour les alcanes, est la même pour le cyclohexane, parce que ce dernier est sans tension sous la forme chaise qu’il adopte préférentiellement; elle est légèrement plus grande pour le cyclopentane (762), mais nettement supérieure pour le cyclobutane (686) et le cyclopropane (696) qui sont très tendus et en réalité très proches de l’éthylène, qu’on peut considérer comme le premier terme («cycloéthane») de la série.Les propriétés chimiques des cyclènes sont à peu près les mêmes que celles des alcènes; cela est vrai au moins pour les cycles normaux (C5 à C7) et pour les grands cycles (C13 et au-dessus), avec l’avantage, pour les premiers, de conduire, par exemple dans les réactions d’addition sur la double liaison, à des composés saturés chez lesquels il n’y a pas rotation libre au niveau de la liaison simple formée, ce qui a permis la détermination aisée de la stéréochimie de nombreuses réactions d’addition sur la double liaison en général.Mais c’est d’abord chez les cycles moyens (C8 à C12) que l’on rencontre des réactions particulières, notamment des réactions trans -annulaires. Ainsi, plutôt qu’au cyclodécane1,2-diol attendu, l’oxydation, par l’acide performique, du trans -cyclodécène 12 conduit, via l’époxyde, aux composés 13, 14, 15, nés de réactions où interviennent, à travers le cycle, divers hydrogènes.Les réactions particulières sont nombreuses chez les cyclobutènes et surtout chez les cyclopropènes, difficiles à isoler parce que fragiles, se polymérisant facilement et possédant même certaines des propriétés des acétyléniques. Par exemple, on connaît des sels de cyclopropénylium, c’est-à-dire des composés où le cycle se présente sous la forme d’un cation stable parce qu’aromatique, la charge positive étant délocalisée sur les trois carbones (16).Préparations et utilisationsLes méthodes de préparation directe des cyclanes, par fermeture d’une chaîne carbonée porteuse de fonctions appropriées, sont peu nombreuses; la seule importante est l’action de certains métaux, comme le zinc, sur les 見, 諸-dihaloalcanes:
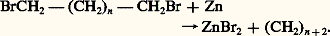 Mais le rendement en cyclane, donc l’intérêt de la réaction, dépend beaucoup de la taille du cycle cherché: excellent pour le cyclopropane, convenable pour le cyclopentane et le cyclohexane, mais très faible pour le cyclobutane et pour les cyclanes au-dessus du cycloheptane; il décroît très vite si le ou les atomes de carbone porteurs de l’halogène sont substitués.Aussi les cyclanes, mis à part les cyclopropanes et les cyclobutanes, sont-ils préparés le plus souvent à partir de composés déjà cycliques et d’accès facile, porteurs de fonctions ou de centres insaturés appropriés. Ainsi, l’hydrogénation catalytique du benzène et du cyclopentadiène conduit respectivement au cyclohexane et au cyclopentane. La réduction du carbonyle des cyclanones en groupement 漣 CH2 漣 (réaction de Wolff-Kishner) permet de préparer les cyclanes en général.Quant à la préparation des cyclènes, elle met en jeu le plus souvent une réaction d’élimination telle que la déshydratation des cyclanols, la débromhydratation des bromures de cyclo-alcoyle, etc.Mention particulière doit être faite des réactions de cyclo-addition , au cours desquelles deux molécules insaturées se combinent pour former un composé cyclique unique. On connaît depuis longtemps la réaction de Diels et Alder qui est une cyclo-addition-1,4, à savoir la formation d’un cycle par soudure de l’un et l’autre des carbones d’une double liaison activée aux deux carbones extrêmes d’un diène conjugué, constituant une excellente méthode de préparation des cyclohexènes. De nombreuses réactions de même type ont été découvertes: cyclo-addition-1,2 dans laquelle les carbones de la double liaison activée se soudent à ceux d’une autre double liaison; cyclo-addition-1,1 où ces deux carbones se soudent à celui d’un carbène (tabl. 4).On connaît de très nombreuses synthèses de cyclopropanes et de cyclopropènes, de cyclobutanes et de cyclobutènes, mettant en jeu des cyclo-additions-1,2 et -1,1 et utilisant des facteurs tels que le chauffage, l’irradiation ultraviolette, etc.L’intérêt pratique des cyclanes est faible; le plus souvent, il repose seulement sur leur inertie chimique, et le cyclohexane, par exemple, est utilisé comme solvant; le cyclopropane est employé comme anesthésique général. Quant aux cyclènes, s’ils interviennent souvent dans la synthèse organique, ils sont assez peu utilisés en tant que tels, sauf certains de ceux qui existent dans les substances naturelles, tel le pinène, principal constituant de l’essence de térébenthine et d’autres terpènes.
Mais le rendement en cyclane, donc l’intérêt de la réaction, dépend beaucoup de la taille du cycle cherché: excellent pour le cyclopropane, convenable pour le cyclopentane et le cyclohexane, mais très faible pour le cyclobutane et pour les cyclanes au-dessus du cycloheptane; il décroît très vite si le ou les atomes de carbone porteurs de l’halogène sont substitués.Aussi les cyclanes, mis à part les cyclopropanes et les cyclobutanes, sont-ils préparés le plus souvent à partir de composés déjà cycliques et d’accès facile, porteurs de fonctions ou de centres insaturés appropriés. Ainsi, l’hydrogénation catalytique du benzène et du cyclopentadiène conduit respectivement au cyclohexane et au cyclopentane. La réduction du carbonyle des cyclanones en groupement 漣 CH2 漣 (réaction de Wolff-Kishner) permet de préparer les cyclanes en général.Quant à la préparation des cyclènes, elle met en jeu le plus souvent une réaction d’élimination telle que la déshydratation des cyclanols, la débromhydratation des bromures de cyclo-alcoyle, etc.Mention particulière doit être faite des réactions de cyclo-addition , au cours desquelles deux molécules insaturées se combinent pour former un composé cyclique unique. On connaît depuis longtemps la réaction de Diels et Alder qui est une cyclo-addition-1,4, à savoir la formation d’un cycle par soudure de l’un et l’autre des carbones d’une double liaison activée aux deux carbones extrêmes d’un diène conjugué, constituant une excellente méthode de préparation des cyclohexènes. De nombreuses réactions de même type ont été découvertes: cyclo-addition-1,2 dans laquelle les carbones de la double liaison activée se soudent à ceux d’une autre double liaison; cyclo-addition-1,1 où ces deux carbones se soudent à celui d’un carbène (tabl. 4).On connaît de très nombreuses synthèses de cyclopropanes et de cyclopropènes, de cyclobutanes et de cyclobutènes, mettant en jeu des cyclo-additions-1,2 et -1,1 et utilisant des facteurs tels que le chauffage, l’irradiation ultraviolette, etc.L’intérêt pratique des cyclanes est faible; le plus souvent, il repose seulement sur leur inertie chimique, et le cyclohexane, par exemple, est utilisé comme solvant; le cyclopropane est employé comme anesthésique général. Quant aux cyclènes, s’ils interviennent souvent dans la synthèse organique, ils sont assez peu utilisés en tant que tels, sauf certains de ceux qui existent dans les substances naturelles, tel le pinène, principal constituant de l’essence de térébenthine et d’autres terpènes.
Encyclopédie Universelle. 2012.
